現在、正式にHL7の標準としてリリースされているのは、2000年11月にANSIの承認を受けている、ANSI/HL7 CDA Release 1.0-2000である。
以下、この、ANSI/HL7 CDA Release 1.0-2000について、本報告書ではRelease Oneと呼ぶことにする。
Release Oneでは、叙述的(narrative)な記述を主とする診療文書を対象としており、文書自体の書誌的な属性な表現については、比較的詳細に定義しているが、文書の内容を表現する本文については、HTMLに準じた文書構造の定義が主となっている。
以下、Release Oneの概要について説明する。
【診療文書に求められる特性への対応】
CDAでは、診療文書に求められる特性として、次のような要件に対応している。
- 保存性(Persistence) 法や規則で定められた期間、変更されることなく保存される
- 管理責任(Stewardship) その診療に責任を持つ個人・団体により管理される
- 真正性(Potential for authentication) 法的な認証の対象となることを前提とする
- 完全性(Wholeness) 認証の対象となるのは文書全体であり、その一部をとりだしても真正性は保証されない
- 見読性(Human readability) 人が正しく理解できる
このように、日本における電子保存の3原則に対応する概念についても、きちんと考慮されていることがわかる。
【CDAの設計方針】
CDAは、「実際に使われる」標準を目指して設計されている。そのために、具体的な設計方針として、次のような方針を掲げている。
- 直接診療に携わる医療従事者による記録に重点を置く
- 標準を実装するにあたっての技術的障壁をできるだけ低くする
- 標準として長年にわたって使用可能とする
- 使用される通信手段、保存手段によらない
- 標準を拡張することなく、ローカルな要件に対応可能とする
これらは、HL7が従来から持ってきた方針もあるが、特に「直接診療に携わる医療従事者による記録に重点を置く」という方針からは、従来からの粗結合のシステム間の通信標準というスタンスから、電子カルテ自体を標準化の対象として正面から取り組む姿勢への変化を反映していると思われる。
【CDAとHL7の他の規格との関係】
CDAを含むHL7 Version 3関連の標準は全てHL7参照情報モデルHL7 RIM(Reference Information Model)をベースとしている。後述のRelease Twoでは、このRIMへの準拠をより進めるべく検討がされている。
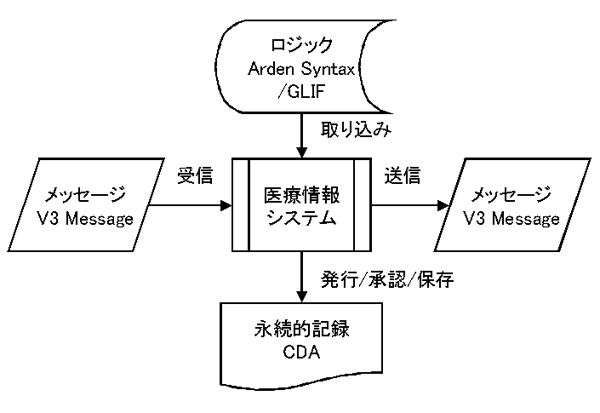
なお、CDAは、医療情報システムにおいて発行・承認・保存される永続的な記録について規定し、システム間で送受信されるメッセージの規格であるV3 Message、特定の状況でのシステムの振る舞いのロジックを表すArden Syntax/GLIFと共にHL7 Version 3による医療情報システムの標準化の大きな柱となっている。(図:V3standards.gif)
【CDAのLevel(Release Oneでの定義)】
Release Oneでは、CDAによる診療文書の表現を、電子情報としてのコード化の程度で次の3段階に分類していた。
Level One: 叙述的(narrative)な記述を主とする診療文書。
文書自体の属性を表現する、CDA Headerについては、詳細に定義。
文書の内容を表現する、CDA Bodyについては、一部コード化の方法は提供するものの、およそHTMLに準じた文書構造のみを定義。
RIMをベースとした、より詳細な診療文書のモデル化への端緒としての位置付けであり、Release OneはこのLevel Oneに相当すると規定されていた。
Level Two: CDA Bodyについて、文章の章立てについてはコード化された診療文書。
文書の種類、診療分野ごとに、章立てのコード化、構造化のバリエーションを持つことを想定。
Level Three:文書の個々の項目までRIMに基づきモデル化された診療文書。
このRelease Oneで想定されていた、Levelの概念はRelease Twoで大きく変わることになるが、それについては後述する。
【CDA Release One文書の構成】
CDA Release One文書は、CDA HeaderとCDA (Level One) Bodyからなる。
(1)CDA Header <clinical_document_header>
診療文書が作成された背景情報を表現する。ヘッダの目的は、施設内、施設間での診療文書の情報交換に必要な情報および診療文書の管理に必要な情報を提供することである。
また、個々の診療文書を、生涯にわたる電子的な健康管理記録として構成するのに必要な情報を提供する。
(2)CDA (Level One) Body <body>
診療文書の中身を構成する、情報(事実)に関する記述が含まれる。
HTMLに類似のマークアップを用いて表現された、叙述的(narrarive)な記述が主体で、一部、表題や値に、情報処理用のコードを埋め込んだり、マルチメディアデータを参照することもできるようになっている。
【CDA Release One文書のCDA Header】
CDA Headerは以下の情報から構成される。
- 文書情報 <document_information>
文書の識別、機密レベルの設定や他の文書との関係を表現する。 - 診療データ <encounter_data>
診療行為が行われた際の状況(日時、場所など)を表現する。 - 医療従事者 <service_actors>
医療提供者、記録者/作成者、報告先、承認者などを表現する - サービス対象 <service_targets>
患者本人および家族などの重要な関係者を表現する。
なお、文書情報では、原版(original)か、追記(addendum)か、 改訂版(revision)かの区別、文書の責任者による確定(承認)の状態、診療文書の分類等が含まれている。
特に文書の種類に着いては、全てのCDA文書は、文書の分類を示す、文書タイプコード(document type code)が必須とされている。
文書タイプコードは、CWE(coded with extensibility)として定義され、ユーザコードの使用が許されているが、HL7とLOINCの連係のもと、HL7のDocument Ontology Task Forceがその任にあたっている。
日本での文書コードと名称をどう扱うか検討が必要である。
【CDA Release One文書のCDA (Level One) Body】
CDA Bodyは以下の基本構造(structure)で構成される。
- セクション<section>
- 段落 <paragraph>
- 箇条書き <list>
- 表 <table>
これらの基本構造の中には、以下の記載要素(entry)が含まれる。
(a)表題<caption>
ひとつの基本構造につきひとつだけ表題をおくことができる。表題のタグ中には項目コード体系と項目コードを指定できる。これにより、その基本構造に記述されている項目(例えば、「主訴」であるとか、「診療プラン」であるとか)をコード化できる。
項目コード体系にはLOINCの使用が想定されている。(ただし必須ではなく、他のコードも項目コード体系を指定することで使用可能。ただし、項目コード体系を表すコードをHL7に発番してもらう必要がある)
LOINCは、Logical Observation Identifier Names and Codesの略で、Regenstrief Instituteが開発・管理する検査、診察等で得られる情報の項目名とそのコードの規格である。
このLOINCの項目コード体系コードは2.16.840.1.113883.6.1である。
(b)基本構成要素の入れ子
基本構造のなかに、さらに基本構造を入れ子の形で持つことができる。
(c)文字データ
通常のキャラクターデータ。Release Oneでは、文字データによる叙述的(narrative)な記述が中心となる。
(d)マルチメディアデータ<observation_media>
外部のマルチメディアデータ(画像、波形データ等)への参照をタグで記述できる。
HTMLのイメージタグに類似。
(e)入れ子可能な情報のくくり <content>
文書を、文、句、語句など好きな大きさに区切ることができる。後述のハイパーリンクや、コード化された情報のリンク先を指定することにも使われる。
(f)標準化された用語・コード <coded_entry>
次のような用途で利用するために、文章中にコードを記述することを可能とする。
- HL7で認知されているコードをCDA文書の記述に用いる。
- 索引の作成を容易にする。
- 検索および情報抽出に利用する。
- 文書中にコードを記述する方法の標準化。
タグ間の参照のメカニズムにより、文書中のどの記述に対してコード化しているのか表現することができるようになっている。
ただし、Release Oneでは、現在、コードの使われている意味を定義する明確な方法がない。たとえば、「胸痛」のコードだけでは、「胸痛」があるのか、「胸痛」がないのか、「胸痛」は原因なのか、結果なのかを示す方法が定められていない。
この点については、Release TwoではRIMに準拠することにより、より詳細で正確な記述が可能とするよう提案されている。
(g)ハイパーリンク
文書中の他の場所、または文書外の情報へのリンクを表現する。HTMLのアンカータグに類似。
【ローカル拡張への対応】
Release Oneでは、<local_header>と<local_attr>という二つのタグを用意して、使用環境に特有なローカルなタグを定義できるようにしている。
<local_header>は、ローカルのタグ記述範囲を規定するのに使われる。
一方、<local_attr>ローカルのXML属性の変換用に用いられる。
ローカルのタグ記述の特徴に応じて、そのタグに対応しない一般の処理系で扱うときの振る舞いを定義するために、次の二つの属性が定義されている。
<local_header ignore=“markup”>
ローカル環境以外では、<local_header>タグで囲まれた記述のタグ部分のみ無視する。
<local_header ignore=“all”>
ローカル環境以外では、<local_header>タグで囲まれた記述は文字データを含めすべて無視する。